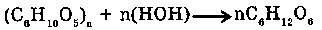Вода - идеальное амфотерное соединение, так как при ее диссоциации образуется равное число ионов H+ и OH-.
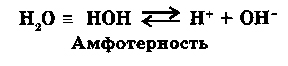
1. С ЩЕЛОЧНЫМИ И ЩЕЛОЧНОЗЕМЕЛЬНЫМИ МЕТАЛЛАМИ:
С натрием, калием и кальцием вода реагирует при обычной температуре; с магнием - при кипении.
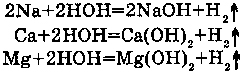
2. С АМФОТЕРНЫМИ МЕТАЛЛАМИ:
С цинком реакция идет при кипячении; с алюминием, если он без оксидной пленки в виде амальгамы (раствор в ртути) - при обычной температуре; с железом - при высокой температуре (красного каления),
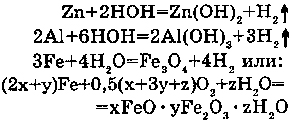
3. С ОКСИДАМИ АКТИВНЫХ МЕТАЛЛОВ:
Например, вода взаимодействует с оксидом калия, оксидом кальция (оксиды всех металлов, стоящих в ряду напряжений до Mg включительно).
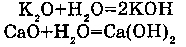
4. С АММИАКОМ:
Вода является донором протона, т.е. по теории Лоури-Бренстеда - кислотой. Поэтому, она способна реагировать с аммиаком, как кислота, с образованием катиона аммония.
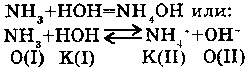
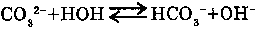
5. ГИДРОЛИЗ СОЛЕЙ:
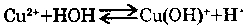
Соли, образованные слабыми основаниями, гидролизуются водой. Например, с хлоридом
меди (II), гидролиз идет ступенчато.
 (I ступень)
(I ступень)
1. С КИСЛОТНЫМИ ОКСИДАМИ: Например, реакция воды с оксидом серы (VI) приводит к образованию серной кислоты.
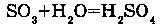
2. С КИСЛОТАМИ:
В данном случае вода является акцептором протона, т.е. по теории Лоури-Бренстеда - основанием. При взаимодействии воды с хлороводородом образуется ион гидроксония (H3O)+.
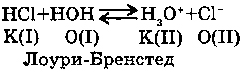
3. ГИДРОЛИЗ СОЛЕЙ
Соли, образованные слабыми кислотами, гидролизуются водой. Для многоосновных кислот реакция идет ступенчато.
 (I ступень)
(I ступень)
Атом кислорода имеет в воде степень окисления -2, что обуславливает свойства воды как восстановителя.
1. С фтором (F2), хлором (Cl2):
Фтор вытесняет кислород. С хлором (Cl2), реакция протекает через образование HCl и HClO.
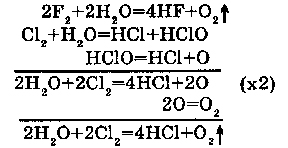
2. РАЗЛОЖЕНИЕ:
Электролиз является реакцией внутримолекулярного окисления-восстановления.
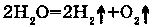
3. С молекулярным кислородом (O):
Вода окисляется кислородом с образованием пероксида кислорода, при этом кислород восстанавливаеся до степени окисления -1.
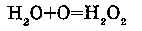
1. С серной кислотой (H2SO4):
С серной кислотой вода образует гидраты.
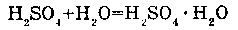
2. С СОЛЯМИ:
Вода с солями может образовывать кристаллогидраты. Например, с сульфатом меди (II).
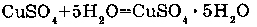
3. С ГАЗАМИ
Образование клатратов (соединений включения газов с структуру воды) связано с проникновением молекул газа в "пустоты", образуемые за счет водородных связей. Эти соединения неустойчивы и существуют за счет слабых межмолекулярных взаимодействий и пространственных затруднений, которые возникают при выходе из "водяного каркаса".
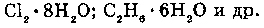
1. С алкенами (CnH2n) (ПРИСОЕДИНЕНИЕ):
Например, при взаимодействии с этиленом получается этиловый спирт. Катализатор - серная кислота.
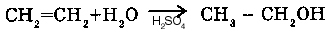
2. С алкенами (CnH2n) (ОКИСЛЕНИЕ):
Взаимодействие этилена с водным раствором перманганата калия ведет к образованию этиленгликоля (реакция Вагнера).
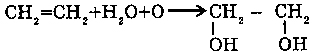
3. С алкинами (CnH2n-2):
В писутствии соли ртути (II) в кислой среде, вода реагирует с ацетиленом, образуя уксусный альдегид (реакция Кучерова).
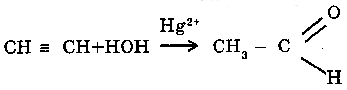
O
Сложные эфиры обратимо гидролизуются водой с образованием соответсвующих кислоты и спирта(реакция идет в присутствии концентрированной серной кислоты).
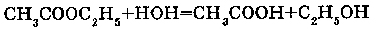
6. С карбидом кальция (CaC2):
Гидролиз карбида кальция идет с образованием ацетилена и Ca(OH)2
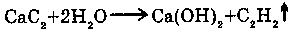
7. С ПОЛИСАХАРИДАМИ:
Гидролиз полисахаридов приводит к образованию моносахаридов. Реакция идет в присутствии кислоты, щелочи или ферментов. Например гидролиз крахмала или клетчатки.